

 |  |
| 您当前的位置 : 天津市中心妇产科医院 > 科研教学 > 工作动态 |
| 研究者发起的临床研究立项流程 |
| 时间: 2025-04-23来源:科教科 |
研究者发起的临床研究立项流程 一、研究者发起的临床研究定义 指以人(个体或群体)为研究对象,不以药品、医疗器械(含体外诊断试剂)等产品注册为目的,研究疾病的病因、诊断、治疗、康复、预后、预防、控制及健康维护等的活动。 二、项目分类: 观察性研究:不对研究参与者施加研究性干预措施,不使其承担超出常规诊疗或疾病防控需要的额外健康风险或经济负担。 干预性研究:基于研究目的施加某种干预措施。 三、立项流程图 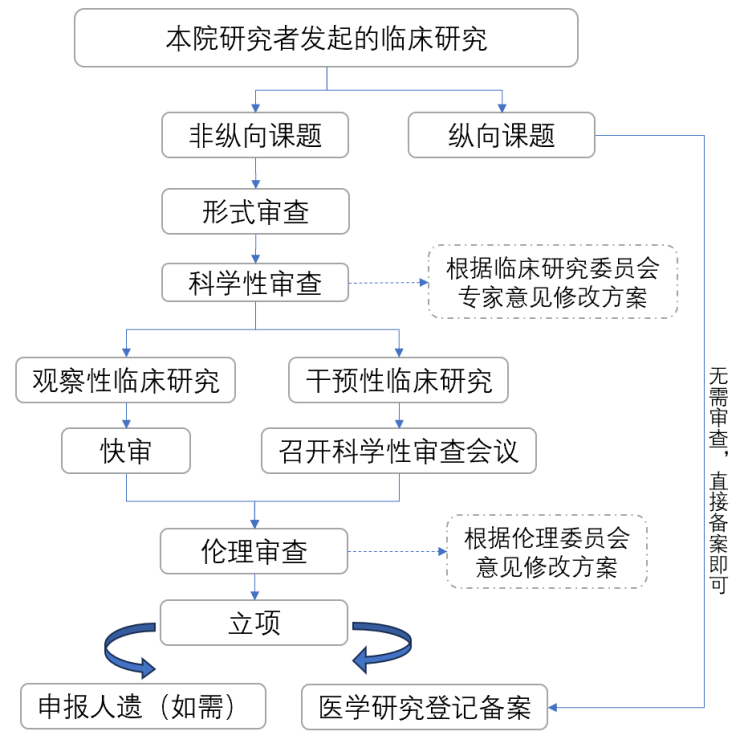 四、具体立项流程 1. 提交资料: 资料下载链接:https://pan.quark.cn/s/a5707fc6529c,或者扫描下方二维码。 
根据《研究者发起的临床研究办理流程和资料列表》(附件1),向临床研究管理委员会秘书递交项目相关资料,将所有材料整个成一个PDF,其中需签字的材料上传扫描版,然后将所有材料电子版发送至秘书(微信号:a18892220500)。 2. 学术委员会审核: 观察性研究:
干预性研究:
3. 国家医学研究登记备案: 伦理审查通过后,即可立项。研究者必须在“国家医学研究登记备案信息系统”(https://www.medicalresearch.org.cn/login)填写和上传临床研究相关信息。 |
| 责任编辑:宣传科 |
|
|